Nanomalzeme kullanımının tarihi çok eskilere dayanmaktadır ve insanoğlu bu malzemeleri çok eski zamanlardan beri farkında olmadan çeşitli uygulamalar için kullanmıştır. Yaklaşık 4500 yıl önce insanlar seramik karışımları güçlendirmek için nanoliflerinden yararlanmıştır. Ayrıca Eski Mısırlıların yaklaşık 4000 yıl önce PbS nanoparçacıklarını eski bir saç boyama formülünde kullandıkları tespit edilmiştir.
Nanomalzemeler, 1 ila 100 nm aralığındaki boyutlarda ve sıfır boyutlu, tek boyutlu, iki boyutlu veya üç boyutlu (sırasıyla 0D, 1D, 2D veya 3D) olarak sınıflandırılan materyallerdir. [1] Nanomalzemelerin rasyonel tasarımı sayesinde olağanüstü yüksek yüzey alanları elde edilebilir. Nanomalzemeler, makro yapılarından önemli ölçüde farklı olan olağanüstü manyetik, elektriksel, optik, mekanik ve katalitik özellikler gösterirler. Fullerenler, karbon nanotüpler, grafen, karbon kuantum noktaları, nano elmaslar, nanogözenekli malzemeler, çekirdek-kabuk nanoparçacıkları, silisen, antimonenler (atom numarası 51 olan parlak gri bir metaloiddir, doğada esas olarak bir sülfür minerali olan stibnit olarak bulunur.), MXenler ( titanyum gibi geçiş metallerinin karbür ve nitrürlerinden yapılmış moleküler tabakalardır/ enerji depolama, ilaç ve optoelektronik uygulamalarda kullanılır.), 2D MOF nano tabakaları (PCN-134(Zn)-2D /PCN = gözenekli koordinasyon ağı), bor nitrür nano tabakaları, katmanlı çift hidroksitler ve metal bazlı nanomalzemeler gibi farklı çeşitlerde nanomalzemeler bulunmaktadır. [1] Şu anda nanomalzemeler boyalar, yüzey kaplamalarında, elektronik, kozmetik, çevresel iyileştirme, spor ekipmanların, sensörler, enerji depolama cihazların ve nanotıp gibi pek çok alanda kullanılmaktadır.[1] Nano malzemeler insan sağlığını iyileştirebilmek ve antibiyotiğe karşı dirençli bakterilerle mücadele edebilmek için önemli bir ajandır. Bazı nanomalzemeler antiviral, antibakteriyel ve antifungal özelliklere sahiptir ve patojenle ilgili hastalıklarla başa çıkmak için mükemmel ajanlardır.[1] Nanomalzemelerin sentezi için iki ana yaklaşım kullanılır: yukarıdan aşağıya yaklaşımlar ve aşağıdan yukarıya yaklaşımlar. Yukarıdan aşağıya süreç bir dökme malzemenin mekanik veya kimyasal enerjiyle daha küçük parçalara ayrılmasını içerir. Aşağıdan yukarıya yaklaşımda ise parçacıkların kimyasal reaksiyon yoluyla boyut olarak artmasına izin veren atomik ve moleküler türlerle başlar. [2]
Nanotıp, nanometre ölçeğinde bir malzeme kullanılarak nanoteknolojinin tıp alanına uygulanmasıdır. Nanotıbbın en yaygın uygulaması, tedavide ilaçların etkisini arttırmak için nanopartiküllerin kullanılmasını içerir. Nanomalzemeler biyolojik olarak kullanılabilmesi için biyouyumlu olmalı ve uzun süreli ya da kısa süreli kullanımda vücutta hasara yol açmamalıdır. Nanomalzemeler nanotıpta 3 farklı alanda tıbbi amaçlarla uygulanabilir: tanı (nanodiognosis), kontrollü ilaç dağıtımı (nanoterapi) ve rejeneratif tıp. Buna ek olarak, teronostik olarak adlandırılan teşhis ve tedaviyi birleştiren yeni bir alan ortaya çıkmıştır ve bu alan hem teşhis/görüntüleme ajanı hem de ilacı aynı sistemde tutan umut verici bir yaklaşımdır. Partikül yüzey enerjisi artırılarak nanomalzemeler çok daha reaktif hale getirilebilir.[2] Nanomalzemeler kişileştirilmiş tıpta, sürekli ilaç dağıtım sistemlerinde (SDDS'ler), anında ilaç dağıtım sistemlerinde (IDDS'ler), hedeflenen ilaç dağıtım sistemlerinde (TDDS'ler) ve uyaranlara duyarlı kontrollü ilaç dağıtım sistemlerinde (CDDS'ler) kullanılmaktadır. Nanopartiküllerin vücuttaki farmakokinetiği ve dağılımının, yüzey fizikokimyasal özelliklerine, şekline ve boyutuna bağlıdır. Örneğin, 10 nm boyutundaki nanopartiküller tercihen kan, karaciğer, dalak, böbrek, testis, timus, kalp, akciğer ve beyinde saptanabilirken daha büyük partiküller sadece dalak, karaciğer ve kanda tespit edilir [2]20-30 nm'nin altındaki küçük nanopartiküller böbrek atılımıyla hızla temizlenirken, 200 nm veya daha büyük partiküller karaciğer, dalak ve kemik iliğinde bulunan mononükleer fagositik sistem (retiküloendotelyal sistem) tarafından daha verimli bir şekilde atılır.[2]

Resim 1:Kanserin mükemmel fototermal tedavisi için nanopartiküller[1]
Nano ölçekte ilaç üretimi biyoyararlanım, çözünürlük, yayılma, ilaç salma profilleri ve immünojenisite gibi özellikler başta olmak üzere geniş bir şekilde ele alınmıştır. Nanomateryalleri ilaç dağıtım sistemleri olarak kullanan hedefli ilaç taşıma sistemleri ikiye ayrılır: aktif ve pasif taşıma. Aktif konumlandırmada parçalar, örneğin peptitler ve antikorlar, onları hedef konumda eklenen reseptör yapılarına bağlamak için ilaç verme sistemi ile birleştirilir. Pasif hedeflemede, ilacın hazırlanan taşıyıcı bileşiği kan akışı sırasında hareket eder. Sıcaklık, ph, şekil ve moleküler bölge gibi özelliklerden etkilenen çekim veya bağlanma ile uygun (hedeflenen) bölgeye yönlendirilir. İnsan vücudundaki başlıca hedefler, hücre zarları, antijenlerin veya proteinlerin üzerinde bulunan reseptörler ve hücre zarının ve yüzeylerinin lipid içerikleridir[3]
Karbon kuantum noktaları, biyolojik görüntüleme ve nanotıp alanlarında önemli bir ilgi görmüştür. RNA ve DNA'nın doğrudan görüntüleri, hücre anatomisini anlamak için gereklidir. Mevcut görüntüleme problarının sınırlamaları nedeniyle bu biyolojik makromoleküllerin dinamiklerini takip etmek kolay bir iş değildir. Son zamanlarda, canlı organizmalarda nükleik asitlerin görüntülenmesi için hücre zarına nüfuz eden karbon kuantum noktaları (CQD) geliştirilmiştir.[1] Tıbbi teşhisin önemli bir yönü, teşhis sonuçları için kullanılan maddenin tespiti ve tanımlanmasıdır. Nanoparçacığın boyutu değiştirilerek çeşitli renkler üretilebildiğinden bu özellikleri tanı testleri sırasında kullanılan malzemelerin renk kodlaması ve etiketlenmesi için kullanışlıdır.[4] Bu teknik kişileştirilmiş tıpta sıcaklık, pH, şekil ve moleküler bölge gibi özellikler kullanılarak hücresel analiz yapılmasını kolaylaştırır.
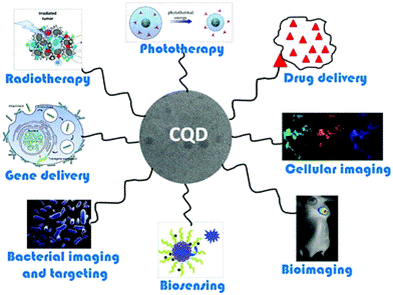
Resim 2:Nanotıpta Karbon kuantum noktaların uygulamaları [1]
Nanotıpta görüntüleme için kullanılan diğer bir yöntem floresan problardır. Biyolojik olarak yanıt veren malzeme bazlı floresan problar, kanser görüntülemede önemlidir. Uyaranlara duyarlı biyolojik olarak yanıt veren malzemeler, düşük pH ve yüksek redoks seviyeleri dahil olmak üzere kanserli mikro ortamın sinyalleri tarafından tetiklenir. Bu problar, tümör bölgesinde güçlü floresans yayar ("AÇIK" durum) ve normal dokularda sessiz kalır (floresans emisyonu olmadan) ("KAPALI" durum).[5]
Nanomalzemelerle ilgili göz ardı edilemeyecek önemli endişelerden biri, hala yeterince anlaşılmayan toksisiteleridir ve bu, çevresel, evsel ve endüstriyel kullanımlarıyla ilgili ciddi bir endişedir. Nanoparçacık bazlı malzemelerin hücresel toksisiteye ne ölçüde katkıda bulunabileceği belirsizdir. Bu yüzden in vivo toksisiteyi azaltmak için nanomalzemelerin hücreler, dokular ve proteinlerle etkileşiminin uygun ve sistematik bir şekilde anlaşılması, nanoteknolojinin güvenli tasarımı araştırılmaya devam edilmektedir.
KAYNAKÇA
[1] N. Baig, I. Kammakakam, W. Falath, and I. Kammakakam, “Nanomaterials: a review of synthesis methods, properties, recent progress, and challenges,” Mater Adv, vol. 2, no. 6, pp. 1821–1871, Mar. 2021, doi: 10.1039/D0MA00807A.
[2] J. Morais Catita et al., “Nanomedicine: Principles, Properties, and Regulatory Issues,” Frontiers in Chemistry | www.frontiersin.org, vol. 1, p. 360, 2018, doi: 10.3389/fchem.2018.00360.
[3] J. Sharifi-Rad et al., “Chitosan nanoparticles as a promising tool in nanomedicine with particular emphasis on oncological treatment,” Cancer Cell International 2021 21:1, vol. 21, no. 1, pp. 1–21, Jun. 2021, doi: 10.1186/S12935-021-02025-4.
[4] “The Benefits of Nanomedicine.” https://www.azonano.com/article.aspx?ArticleID=4654 (accessed Sep. 03, 2022).
[5] L. Gong et al., “Polymeric Nanoreactors with Chemically Tunable Redox Responsivity,” ACS Appl Mater Interfaces, Aug. 2022, doi: 10.1021/ACSAMI.2C07663.
